系统性硬化症(SSc),也称为硬皮病,是一种自身免疫性结缔组织病,其特征为皮肤和内脏器官的纤维化并伴血管病变,多数患者可出现脏器受累(包括心、肺、肾、消化道、神经系统等),一旦重要脏器受累往往治疗效果较差且死亡率高。本文将重点介绍SSc的相关脏器受累及临床管理策略。
01、肺部受累
肺部受累是SSc最常见并发症之一,也是SSc患者死亡的重要原因之一,严重影响患者的预后。其中,以间质性肺病和肺动脉高压最为常见。
1.间质性肺病(ILD)
SSc在诊断4-5年内出现病情进展、并发ILD的风险最大,且ILD是SSc患者死亡的主要原因。SSc相关间质性肺病(SSc-ILD)在SSc患者中的发生率高达为90%,其中约80%患者可表现为严重的肺纤维化,25%-30%患者发展为进行性ILD[1]。大部分SSc-ILD患者初期无呼吸系统相关症状,容易被漏诊,需行胸部高分辨率CT(HRCT)检查以明确。SSc-ILD随病情进展可表现为干咳、活动耐受量降低、胸闷、气短、呼吸困难等症状,逐渐出现进行性加重的呼吸困难,终末期可发展成呼吸衰竭及右心衰。体格检查时,双侧肺基底部听诊可闻及“Velcro”啰音。HRCT主要表现为磨玻璃样改变、网状影,病变部位主要以双肺下部多见,终末期可呈蜂窝肺。
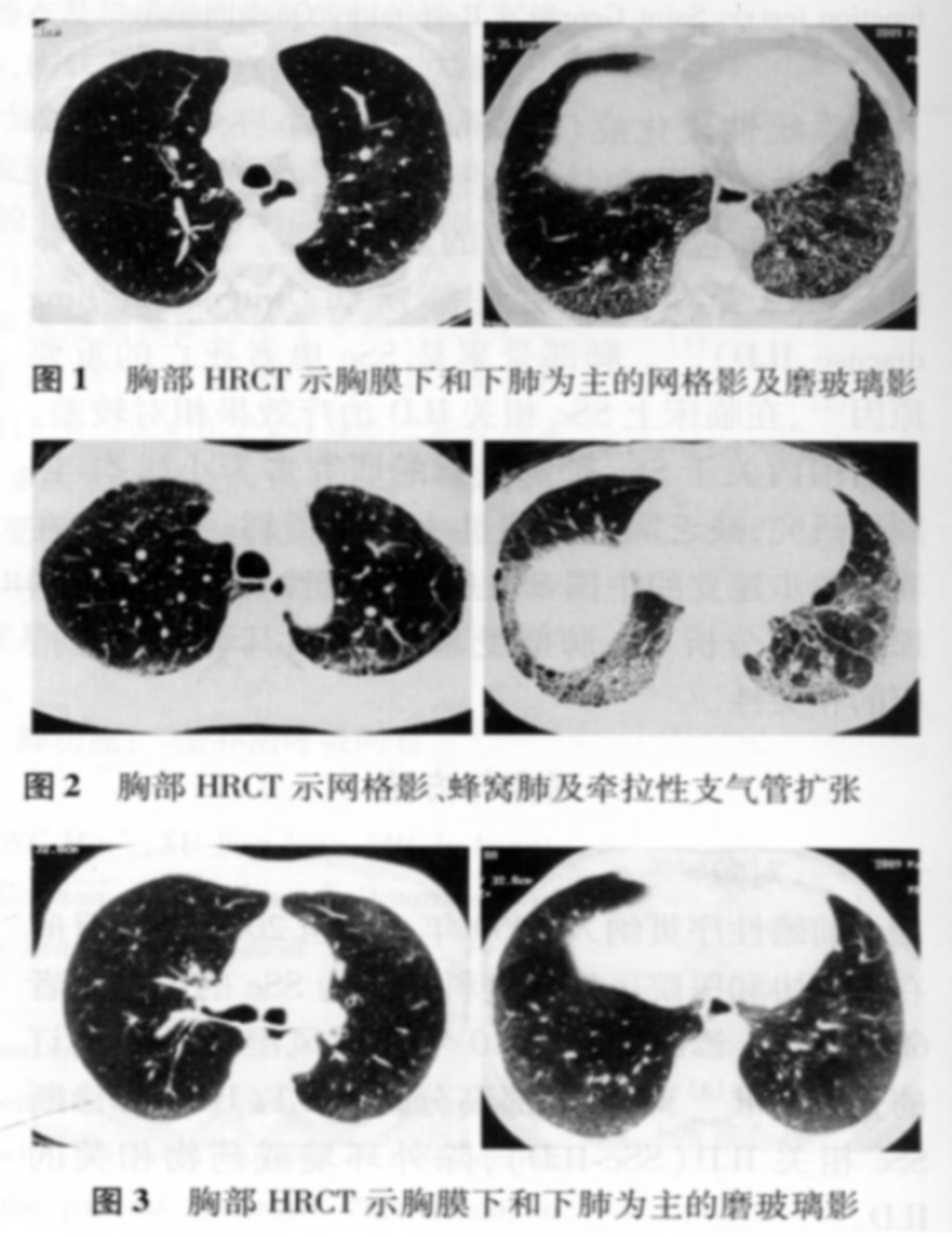
(图片来自《系统性硬化症的肺部表现》)
临床管理及治疗建议:
2016年欧洲抗风湿病联盟(EULAR)和硬皮病试验研究组织(EUSTAR)发布了SSc的治疗推荐更新(以下简称2016 EULAR/ EUSTAR指南),对SSc-ILD的治疗推荐为[5]:SSc-ILD治疗的主要药物是免疫抑制剂,包括环磷酰胺(CYC)和霉酚酸酯(MMF),这两种药物均能持续改善患者的用力肺活量(FVC);其中与MMF相比,使用CYC治疗的患者,耐受性较差,并有一定的毒副作用,停药比例略高。
同年英国风湿病学学会(BSR)和英国风湿病学卫生专业人员协会(BHPR)共同发布了SSc治疗指南(以下简称2016 BSR/ BHPR指南),SSc-ILD的治疗推荐为[6]:
1)所有SSc患者均应评估有无肺纤维化及其程度;治疗方案应根据疾病的广泛度、严重度及恶化的可能性来决定(I,A);
2)首先推荐使用CYC治疗(Ⅰ、A/B),MMF 可用作CYC 的备选药物或后续用药(II,B)。
2.肺动脉高压(PAH)
PAH是多种结缔组织病的常见并发症,且在亚洲人群中尤为突出[2]。约15%SSc患者会出现PAH,PAH可出现于SSc的任一时期,且与其他结缔组织病相比,SSc相关肺动脉高压(SSc-PAH)的脑钠肽水平最高、生存率最低[3]。PAH与ILD类似,起病也较为隐匿,早期常常无任何症状,随病情进展出现活动后胸闷气急、呼吸困难、胸痛等症状。SSc患者一旦出现PAH,将严重影响患者的预后,且治疗支出可能大幅度增加,因此早期诊断就显得十分必要。可采用多种方法辅助诊断,包括心电图、6min步行试验及心脏超声等,其中右心导管检查是诊断PAH的金标准,但由于其具有一定的有创性,因此心脏超声检查已成为临床上筛查和诊断PAH(尤其是中重度PAH)的主要方法之一,其灵敏度可达90%,特异度可达75%以上[4]。
临床管理及治疗建议:
2016EULAR/ EUSTAR指南建议:SSc-PAH的主要治疗药物有三大类:前列环素类药物、内皮素受体拮抗剂、一氧化氮刺激剂。经右心导管检查确诊PAH后,应至少使用一种药物进行治疗。
2016 BSR/ BHPR指南对SSc-PAH的治疗推荐为:
1)推荐对所有SSc患者均进行肺动脉高压评估,在专业中心诊治(Ⅰ、A)。
2)诊断肺动脉高压时应分析右心漂浮导管检查等的检查结果,依据诊断标准诊断,还应进一步评估 SSc 相关的心脏和肺部并发症(Ⅰ、A)。
02、消化道受累
消化道是SSc最常受累器官之一,可影响从食管到肛门的任何部位,其中食管受累最常见,以运动障碍为主,肛门和直肠次之,小肠和结肠较少。早期症状较轻,往往无自觉症状而延误诊治,晚期可出现严重胃肠功能紊乱、消化道出血、吸收不良综合征等。
(图片来源:360图库)
1.食管
食管是SSc最常受累的消化道部位,占70%-90%[7]。临床表现为进食哽咽感、胸骨后梗阻感,伴烧心、反酸及恶心呕吐等。随着病情的进展,可逐渐加重引起糜烂性食管炎、出血、食管下部狭窄等并发症,甚至吞咽功能丧失,严重影响患者的生存质量。值得一提的是,1/3的SSc患者可发生Barrett食管,从而导致发生腺癌等并发症的危险性增高。
2.胃
10%-80%的患者有胃部不适的症状,其症状主要表现为恶心、呕吐、腹胀等,可伴有食欲减退和体质量下降[7]。部分患者的胃功能异常可能与胃蠕动功能下降有关,此外,SSc也可引起胃腺体的黏液分泌减少,抗酸能力下降,增加了萎缩性胃炎、溃疡等并发症发生的风险。
3.肠道
15%~60%的SSc患者伴有肠道受累的表现,但由于肠道受累的临床表现缺乏特异性(如腹胀、腹泻、便秘等),且其检测手段较为受限,导致诊断率有可能被低估[7]。SSc肠道功能异常除了表现为动力异常和自主神经功能障碍外,肠道菌群的过度繁殖也是导致腹泻、营养不良和体质量下降的常见原因。
4.肛门直肠
肛门直肠是SSc患者第二容易受累的消化道部位,有50%~70%的SSc患者表现出此部位功能障碍,仅次于食管[7]。在此影响下,患者在排便时容易感到排便费力、排便不尽感,并继发便秘引起粪便滞留,进一步导致直肠肠腔膨胀扩张引发恶性循环。
临床管理及治疗建议:
2016EULAR/ EUSTAR指南建议:治疗可通过简单的抗反射措施,如在睡前几个小时抬高床头,不进食,同时联合抑酸治疗,特别是质子泵抑制剂(PPI)作为消化道受累的一线治疗药物,能使患者得到明确的临床获益。胃和小肠动力失调,可用促胃肠动力药物治疗。
2016 BSR/ BHPR指南的治疗推荐为:
1)推荐使用质子泵抑制剂和组胺H2 受体拮抗剂治疗胃食管反流和吞咽困难,可能需要长期用药(Ⅲ、C)。
2)促胃肠动力药多巴胺拮抗剂可用于治疗吞咽困难和胃食管反流(Ⅲ、C)。
3)对严重的体重减轻或肠内营养效果不佳的患者,可考虑给予肠外营养支持治疗(Ⅲ、C)。
4)推荐间断给予广谱抗生素口服治疗小肠细菌过度生长,轮替使用可能也有益(Ⅲ、C)。
5)可使用止泻药或泻药治疗患者的腹泻或便秘(Ⅲ、C)。
03、肾脏受累
SSc肾脏受累的主要类型包括:硬皮病肾危象、慢性肾疾病和炎症性肾损害,尤其高发于弥漫型SSc 患者,治疗延误有致命危险。硬皮病肾危象是风湿免疫性疾病的一个急症,需要早期诊断和积极治疗以保护肾功能。约5%-10%的SSc患者可发生硬皮病肾危象[6],是SSc的严重并发症之一。典型硬皮病肾危象表现为突然出现高血压和急进性肾损害,这主要与高水平的肾素有关。
研究发现,硬皮病肾危象的危险因素包括[6]:病程<4年;广泛且进展快速的皮肤增厚;新发贫血;新发心血管事件;抗RNA 聚合酶Ⅲ抗体阳性;使用糖皮质激素治疗(泼尼松剂量> 15 mg/d)。
临床管理及治疗建议:
2016EULAR/EUSTAR指南建议:尽早使用血管紧张素转化酶抑制剂(ACEI)治疗;如使用糖皮质激素治疗,应密切监测血压及肾功能。
2016 BSR/ BHPR指南的治疗推荐为:
1)对有硬皮病肾危象风险的患者需密切监测血压,至少每周1 次(Ⅲ、C)。
2)早期识别并及时接受ACEI治疗的患者的预后较好(Ⅲ、C)。
3)其他降压药可与ACEI联合用于治疗SSc 相关的顽固性高血压治疗(Ⅲ、C)。
04、心脏受累
心脏受累可以是SSc直接所致,也可以是由继发性疾病如PAH导致,心脏受累通常提示预后欠佳,死亡率高。心脏受累常见表现有心包积液、心律失常和心脏舒张功能障碍,急性心肌梗死较为罕见,严重的心肌病可能与肾危象和全身性肌炎有关。
临床管理及治疗建议:
2016 BSR/ BHPR指南对SSc心脏病变的治疗推荐为:
对收缩性心力衰竭:
1)使用免疫抑制剂治疗或考虑植入心脏起搏器(Ⅳ、D)。
2)可考虑使用植入式心律转复除颤器(Ⅲ、D)。
3)可使用ACEI及卡维地洛治疗;也可使用选择性β 受体阻滞剂治疗,但可能加重雷诺现象(Ⅳ、D)。
对左心室射血分数保留的舒张性心力衰竭:
1)使用利尿剂、包括安体舒通和呋塞米治疗(Ⅳ、D)。
2)有临床研究显示,钙离子通道阻滞剂可减少SSc患者的收缩性心力衰竭发生率。
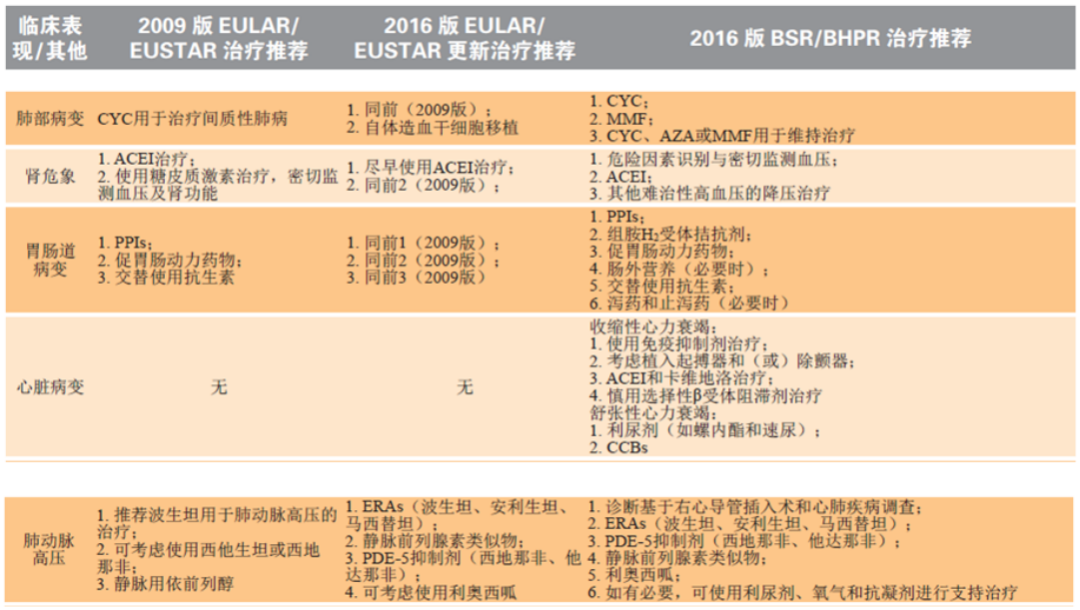
(有关SSc治疗的EULAR/EUSTAR2009 版、2016 版以及BSR/BHPR 2016 版比较)
结语与展望
迄今为止,SSc仍然是一种富有挑战性的疾病,作为罕见病,发病率低,人们对其重视程度不足、认识有限。目前,SSc单一的治疗方式效果不佳,且缺乏非常有效的药物,我们需要规划一个整体的临床管理治疗策略,包含胃肠道功能障碍、雷诺现象以及更为严重的影响生存率的心、肺、肾等脏器受累。而规律的疾病监控以及内脏器官检查有利于SSc患者的早期诊断和治疗。
近年来虽然尚无经大规模随机对照研究验证有效提高SSc生存率的治疗策略,但证据显示依靠目前的治疗方案,死亡率在明显下降[8]。因此,我们需要更好的临床治疗管理策略,进一步降低SSc患者的死亡率,提高生存率及生活质量。相信随着医学的进步和发展,对于SSc的认识不断深入,治疗管理方案会更加完善!